图1. “三位一体”的细菌性炎症治疗策略
抗生素后效应(Post-antibiotic effect, PAE)是评价药物抗菌疗效的一个重要指标,反映了当抗菌药物进入机体后经吸收分布转运代谢,局部药物降低至有效抑菌浓度后,仍然可以持续抑制细菌生长的能力。作为PAE的一个分支学说,抗生素后白细胞增强效应(
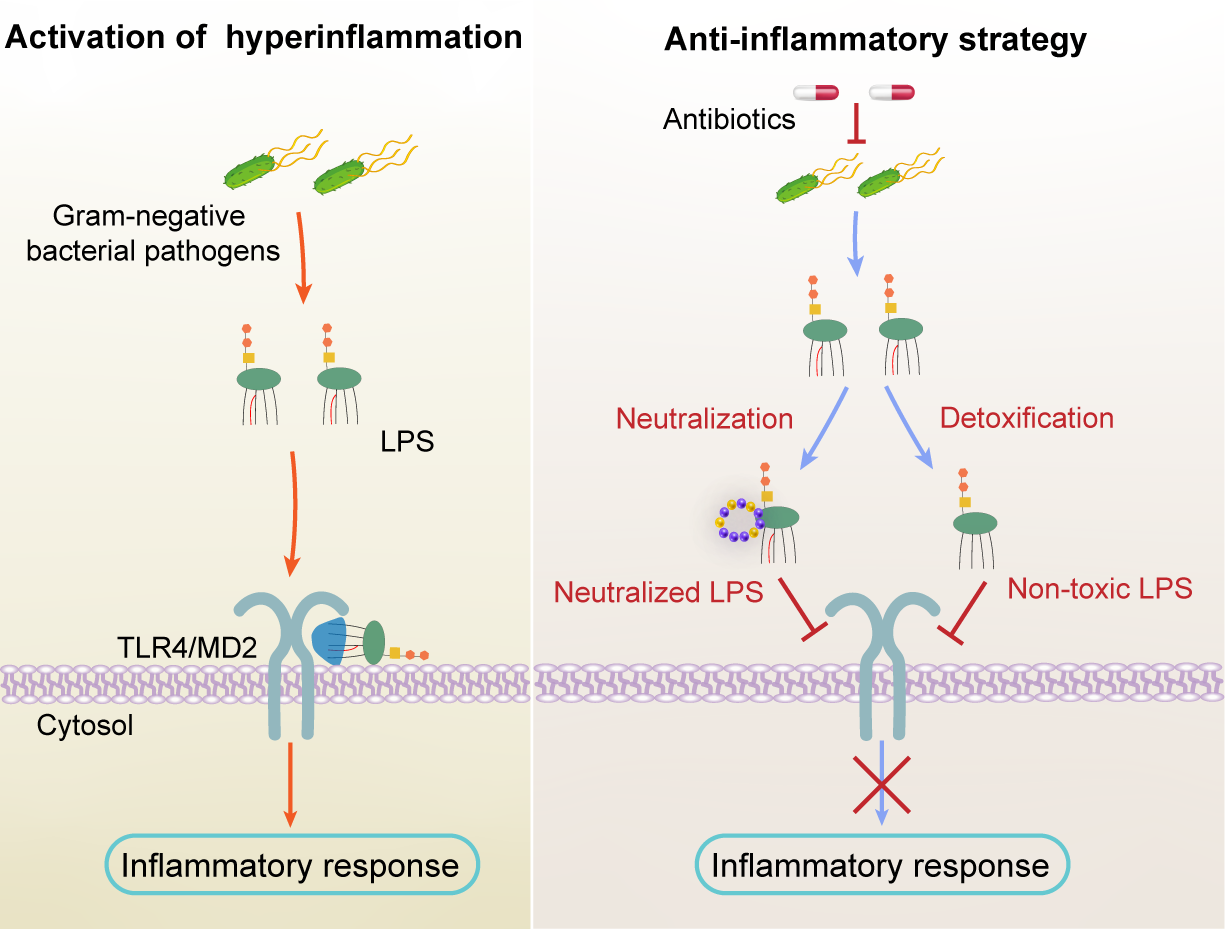
图1. “三位一体”的细菌性炎症治疗策略
抗生素后效应(Post-antibiotic effect, PAE)是评价药物抗菌疗效的一个重要指标,反映了当抗菌药物进入机体后经吸收分布转运代谢,局部药物降低至有效抑菌浓度后,仍然可以持续抑制细菌生长的能力。作为PAE的一个分支学说,抗生素后白细胞增强效应(Post-antibiotic leukocyte enhancement, PALE)侧重于抗生素作用于细菌后吞噬细胞抗菌能力增强。长期以来,上述现象通常被归因于抗生素导致的细菌致敏,即抗生素处理后的细菌更易被白细胞吞噬并清除。目前,关于宿主细胞在PAE和PALE中的作用机制尚不明确。该研究基于病原菌与宿主细胞互作模型,探究了在抗生素降低至有效抑菌浓度后,巨噬细胞如何持续抑制胞内病原菌的生存。作者首先构建了抗菌药物作用下的巨噬细胞与病原菌感染模型,发现氟喹诺酮类药物如恩诺沙星可有效减少近70%的细胞内金黄色葡萄球菌及其他多种细菌。抗菌药物不仅显著提升了细胞内活性氧水平,同时还促进了与胞内病原菌共定位的活性氧在髓过氧化物酶的作用下转变为次氯酸,显著提升巨噬细胞杀死胞内菌的效率。进一步对细胞内活性氧产生及降解通路的剖析,发现恩诺沙星不仅适度干扰了巨噬细胞电子传递链功能来促进线粒体活性氧的大量产生,而且还可以通过拓扑异构酶2-转录激活因子4-过氧化氢酶通路来减少抗氧化酶的表达,导致更多活性氧在细胞内累积,加速病原菌的清除。
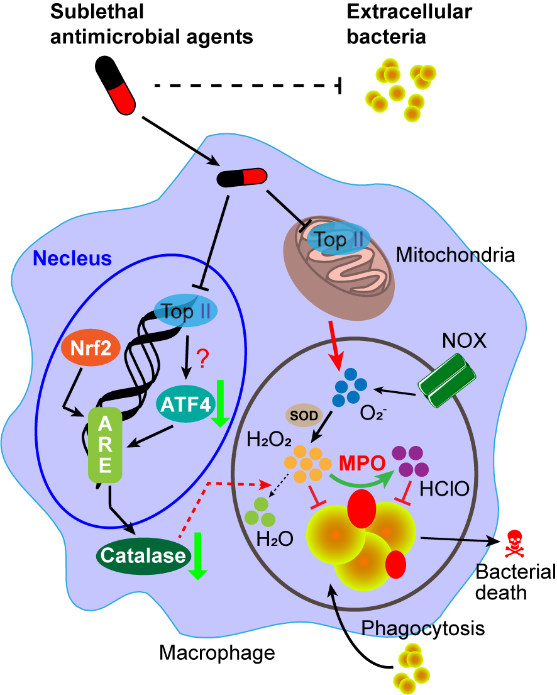
图2. 抗菌药物诱导活性氧存进胞内病原菌清除
越来越多的研究发现,病原菌相关的多重感染通常与较差的临床预后和较高的死亡率呈正相关。以宿主广泛携带的肠球菌为例,肠球菌自身不仅可以引起感染,还可促进不同病原体定殖、扩散和致病性,削弱抗菌药物治疗效果,造成反复感染和治疗失败等严重后果,给动物和人类健康带来巨大威胁。作者全面系统地总结了肠球菌的感染特性、介导多重感染类型、促进多重感染机制的最新研究进展,提出多重感染的治疗新策略,将肠球菌作为潜在的治疗靶点,采用多靶点或联合治疗策略,同时靶向“促进因子”肠球菌和病原体达到有效根除或减少多重感染(图3)。
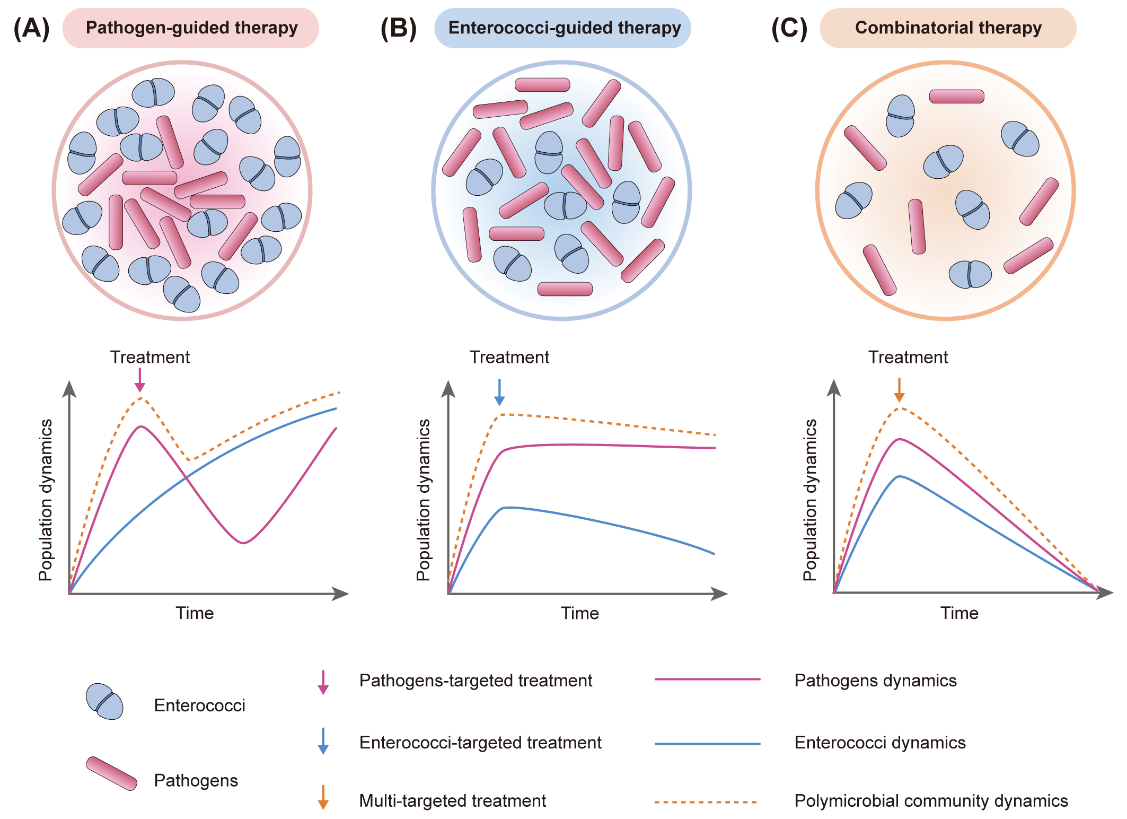
图3.多重感染治疗的新策略
沈建忠院士团队的博士研究生李小玉和博士毕业生曲少奇,博士毕业生吴逸璠以及博士毕业生徐文娇和硕士毕业生方钰文分别为三篇论文的第一或共同第一作者,朱奎教授和沈建忠院士为《先进科学》(Advanced Science)共同通讯作者,朱奎教授为《前沿研究杂志》(Journal of Advanced Research)和《微生物学趋势》(Trends in Microbiology)通讯作者。本研究受国家自然科学基金重点项目等资助。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302950
https://www.sciencedirect.com/science/article/pii/S2090123223001480
https://authors.elsevier.com/a/1hX-a_,2CiQu78l
本文链接:http://news.cau.edu.cn/kxyj/87c881b4202c4d97a4e88aacf22515ee.htm



